La percepció visual s’inicia amb la captació de la llum per les cèl·lules fotoreceptor de la retina, bastons i cons, que mitjançant una cascada enzimàtica d’amplificació la converteixen en un senyal elèctric que es transmet a a neurones d’ordre superior i al cervell.
Les cèl·lules fotoreceptor mesuren i transmeten en cada moment la intensitat de llum en cada punt del camp visual. Ho fan amb una sensibilitat extraordinària, alhora que amb la capacitat de modular aquesta sensibilitat depenent de la llum ambiental. Aquesta capacitat de modulació és essencial per poder manejar-se en el món natural, en què la llum ambiental varia constantment.
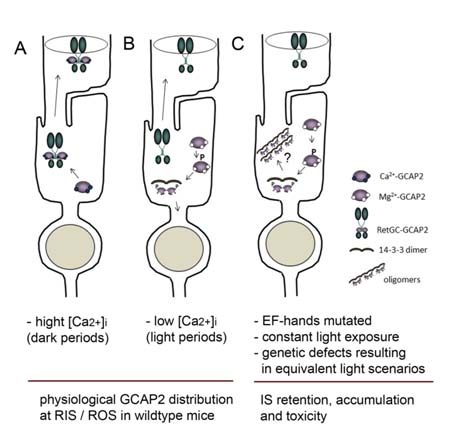
La capacitat de modular la resposta a la llum depenent de la llum de fons, l’adaptació a la llum, resideix en un senyal de calci. La llum, a més de canviar el potencial de membrana dels fotoreceptors, produeix una baixada de calci en la cèl·lula. Aquesta baixada de calci coordina un senyal de retrorregulació de la cascada enzimàtica de fototransducció a diversos nivells, que contraresta l’amplificació. Aquest senyal de regulació està intervinguda per proteïnes d’unió a calci (neuronal calcium sensor proteins, NCS), entre les quals es troben les proteïnes activadores de l’activitat guanilat ciclasa o GCAPs, per les seves sigles en anglès.
La línia d’investigació dirigida per Ana Méndez a l’Idibell té com un dels seus objectius caracteritzar les bases moleculars de l’adaptació a la llum, el paper de les proteïnes GCAP en aquest procés, i entendre com errors genètics a aquest nivell condueixen a diferents formes de ceguesa hereditària. Un treball recent del grup que es publica ara a PLoS Genetics, revela que quan falla la transició conformacional en una d’aquestes proteïnes sensors de calci en fotoreceptors, GCAP2, de la forma “lliure de Ca2 +” a la forma “unida a Ca2 +”, es desencadena una degeneració retinal severa que difereix mecanísticament de la distròfia retinal associada a errors genètics en GCAP1.
L’estudi demostra com en el cas de GCAP2 la proteïna en la seva forma lliure de calci no es distribueix al compartiment sensorial, sinó que s’acumula en el segment intern de la cèl·lula després de ser fosforilada i retinguda per la seva unió a 14-3-3. És aquesta acumulació de la proteïna en el segment erroni el que comporta a la mort cel·lular. L’estudi revela un nou mecanisme fisiològic de control de la distribució de GCAP2 a la cèl·lula íntimament lligat a malaltia, en el sentit que una desregulació greu d’aquest mecanisme condueix a una degeneració retinal ràpida en models murins.
L’estudi proposa que aquest mecanisme podria contribuir a explicar la patologia d’aquelles cegueses causades no només per mutacions en GCAP2 que alterin la seva afinitat d’unió a calci; sinó també per exposicions prolongades a llum intensa, o per mutacions en gens que resultin en una situació equivalent a l’exposició a llum intensa, bé per causar activació constitutiva o per causar defectes en terminació, els globalment referits com desordres “llum-equivalent”.