La percepción visual se inicia con la captación de la luz por las células fotorreceptor de la retina, bastones y conos, que mediante una cascada enzimática de amplificación la convierten en una señal eléctrica que es transmitida a neuronas de orden superior y al cerebro.
Las células fotorreceptor miden y transmiten en cada momento la intensidad de luz en cada punto del campo visual.
Lo hacen con una sensibilidad extraordinaria, a la vez que con la capacidad de modular esta sensibilidad dependiendo de la luz ambiental.
Esta capacidad de modulación es esencial para poder manejarse en el mundo natural, en que la luz ambiental varía constantemente.
La capacidad de modular la respuesta a la luz dependiendo de la luz de fondo, la adaptación a la luz, reside en una señal de calcio.
La luz, además de cambiar el potencial de membrana de los fotorreceptores, produce una bajada de calcio en la célula.
Esta bajada de calcio coordina una señal de retrorregulación de la cascada enzimática de fototransducción a varios niveles, que contrarresta la amplificación.
Esta señal de regulación está mediada por proteínas de unión a calcio (neuronal calcium sensor proteins, NCS), entre las que se encuentran las proteínas activadoras de la actividad guanilato ciclasa ó GCAPs, por sus siglas en inglés.
La línea de investigación dirigida por Ana Méndez en el Idibell tiene como uno de sus objetivos caracterizar las bases moleculares de la adaptación a la luz, el papel de las proteínas GCAP en este proceso, y entender cómo fallos genéticos a este nivel conducen a distintas formas de ceguera hereditaria.
Un trabajo reciente del grupo que se publica ahora en PLoS Genetics,
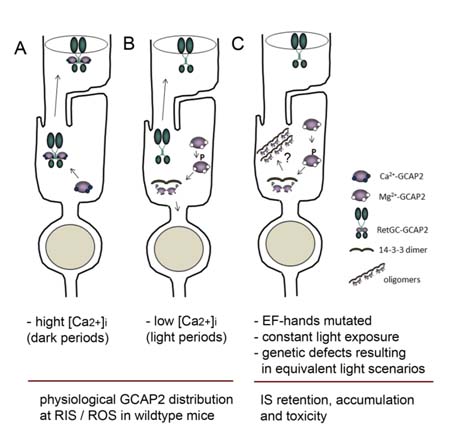
revela que cuando falla la transición conformacional en una de estas proteínas sensoras de calcio en fotorreceptores, GCAP2, de la forma “libre de Ca2+” a la forma “unida a Ca2+”, se desencadena una degeneración retinal severa que difiere mecanísticamente de la distrofia retinal asociada a fallos genéticos en GCAP1.
El estudio demuestra cómo en el caso de GCAP2 la proteína en su forma libre de calcio no se distribuye al compartimento sensorial, sino que se acumula en el segmento interno de la célula tras ser fosforilada y retenida por su unión a 14-3-3.
Es esta acumulación de la proteína en el segmento erróneo lo que conlleva a la muerte celular.
El estudio desvela un nuevo mecanismo fisiológico de control de la distribución de GCAP2 en la célula íntimamente ligado a enfermedad, en el sentido de que una desregulación grave de este mecanismo conduce a una degeneración retinal rápida en modelos murinos.
El estudio propone que este mecanismo podría contribuir a explicar la patología de aquellas cegueras causadas no sólo por mutaciones en GCAP2 que alteren su afinidad de unión a calcio; sino también por exposiciones prolongadas a luz intensa, o por mutaciones en genes que resulten en una situación equivalente a la exposición a luz intensa, bien por causar activación constitutiva o por causar defectos en terminación, los globalmente referidos como desórdenes “luz-equivalente”.
25/07/2014
Describen un mecanismo relevante en ciertos tipos de ceguera hereditaria